الألكانات
الألكان في الكيمياء العضوية هو هيدروكربون متشبع مؤلف من سلسلة مفتوحة غير حلقية والتى فيها يكون الجزيء به الحد الأقصي من ذرات الهيدروجين وبالتالي لا يكون بها روابط ثنائية.
الألكانات تعرف أيض بإسم برافينات, أو إجمالا "سلسلة البرافينات" وهذه المصطلحات يمكن أن تستخدم أيضا للألكينات والتى تكون ذرات الكربون بها سلسلة أحادية, غير متفرعة, وعند وجود تفرعات في سلسة الألكانات تسمي "أيزوبرافينات" وتنتمى الألكانات للمركبات الأليفاتية.
المعادلة العامة لتركيب الألكانات CnH2n+2, وأبسط ألكان على هذا يكون الميثان, CH4, ويليه الإيثان, C2H6, وهكذا. وكل ذرة كربون في الألكانات لها تهجين sp3
التزامر (الأيزوميرزم) " Isomerism"
يمكن للجزيئات التى تحتوى على أكثر من 3 ذرات كربون أن تترتب بعدة طرق, مكونة أيزومرات عديدة. الألكانات "العادية" لها تركيب خطي, غير متفرع. ويزيد عدد المتماكبات بشدة بزيادة عدد ذرات الكربون, فعدد الأيزومرات للألكانات التى لها من 1 إلى 12 ذرة كربون تكون كالتالي: 1, 1. 1, 2, 3, 5, 9, 18, 35, 75, 159, 355 بالترتيب.
تسمية الألكانات
نظام IUPAC
ينتهى اسم الألكان باللاحقة "ان". الحلقات المستقيمة للألكانات والتى بها 8 أو أقل من ذرات الكربون يتم تسميتها طبقا للجدول التالي, والذى يحتوى أيضا على اسم الألكيل المتكون بنزع ذرة الهيدروجين الطرفية.
الألكانات المتفرعة يتم تسميتها طبقا للآتى:
تحديد أطول سلسلة متصلة لذرات الكربون.
ترقيم الذرات بداية من أحد الأطراف حتى الطرف الأخر, على أن يكون طرف البداية هو الأقرب لمجموعات التفرع في حالة وجودها.
تحديد المجموعات المتصلة بالسلسلة بالترتيب وبداية كتابة اسم الألكان كالتالي:
رقم ذرة الكربون المتصلة بمجموعات فرعية, وفى حالة وجود أكثر من تفرع يتم كتابة أرقام التفرع بترتيب الترقيم في السلسلة الرئيسية ( 3,2- وليس 2,3- . 4,1- وليس 1,4- . وهكذا)
فى حالة وجود إتصال لنفس المجموعة أكثر من مرة بسلسة الألكان, نستخدم البادئات التالية طبقا لعدد مرات التكرار: " ثنائي", "ثلاثي", "رباعي", وهكذا.
إسم المجموعة أو المجموعات المتصلة بالسلسلة, بنفس ترتيبها طبق لترقيم السلسلة.
ينتهى الإسم بكتابة اسم أطول سلسلة مستقيمة.
ولتنفيذ هذه الخطوات, يجب أن نعرف اسم المجموعات المتصلة بالسلسلة. وهذا يتم بنفس الطريقة السابقة فيما عدا انه يتم ترقيم المجموعة بداية من أول ذرة كربون متصلة بسلسلة الألكان, وفى إتجاه أطول سلسلة بداية من هذه النقطة, وليس طبقا لأطول سلسلة موجودة في المجموعة.
فمثلا المركب (1) في الشكل القادم هو الإحتمال الوحيد لوجود تفرع في البيوتان. وإسمه الرسمي 2-ميثيل بروبان, بينما البنتان يمكن أن يكون له 2 متزامر (isomer), بالإضافة إلى شكل سلسلته المستقيمة.الشكل (2) 2,2- ثنائي ميثيل بروبان, الشكل (3) 2-ميثيل بيوتان.
الخواص
الخواص الفيزيائية
*الألكانات لا تذوب في الماء.
*كثافة الألكانات أقل من الماء.
*تزيد نقطة الإنصهار والغليان للألكانات بصفة عامة بزيادة الوزن الجزيئي وأيضا بزيادة طول سلسلة الكربون الرئيسية.
*فى الظروف القياسية فإن الألكانات من CH4 إلى C4H10 تكون في الحالة الغازية, ومن C5H12 إلى C17H36 تكون في الحالة السائلة, وبعد C18H38 تكون في الحالة الصلبة.
الخواص الكيميائية
الألكانات نشاطيتها منخفضة لأن الروابط الاحادية بين C-C, و C-H تكون ثابتة نسبيا, وصعبة التكسير وغير قطبية. ولا تتفاعل الألكانات مع الأحماض, الألكيلات, الفلزات, العوامل المؤكسدة. ومن العجيب أن النفط (أوكتان) لا يتفاعل مع حمض الكبريتيك المركز, فلز الصوديوم, منجنيز البوتاسيوم. وهذا الخمول هو أصل كلمة "برافينات" (الأصل اللاتيني "بارا"+"أفين", يعنى هنا لا يوجد إنجذاب).
التفاعلات
التكسير
التكسير هو تكسر الجزيئات الكبيرة إلى جزيئات أصغر. ويمكن أن يتم هذا إما بالحرارة أو بإستخدام عامل حفاز. يتبع عملية التكسير الحراري آلية تماثل, أى انه, تتكسر الروابط بتماثل وتنتج أزواج من الجذور الحرة (Free Radiacl). ويتضمن التكسير الحفزى تواجد حمض حفاز (غالبا ما يكون حمض صلب مثل سيليكا-ألومينا وزيولايت) وهذا يؤدى لتكسير غير متماثل للروابط مما ينتج أزواج من الأيونات بشحنات متضادة, غالبا كاتيون كربوني أو شرجبة كربونية ، وأنيون الهيدريد ( شرسبة الهيدريد الغير ثابت. الشق الحر لذرات الكربون المتمركزة والكاتيونات ثابتهم ضعيف للغاية, وبالتالى يحدث إعادة ترتيب للسلسلة, يحدث إنقسام C-C في الموضع بيتا (تكسر) وينتقل الهيدروجين داخل الجزيئات, وبين الجزيئات أو إنتقال هيدريد. وفى كل من العمليتين, فإن المتفاعلات الوسيطة (شق, أيونات) تتجدد بإستمرار, أى أنه يكون لها نظام تجدد ذاتي. وتنتهى سلسلة التفاعل في أخر الأمر بإتحاد شق أو أيون.
مثال للتكسير ف ىالبيوتان CH3-CH2-CH2-CH3
الإحتمال الأول )48 %) أن يحدث التكسر عند CH3-CH2 bond.
CH3* / *CH2-CH2-CH3
وبعد عدد معين من الخطوات, سيتم الحصول على ألكان و ألكين.
CH4 + CH2=CH-CH3
الإحتمال الثانى (38 %) أن يحدث التكسير عند CH2-CH2 bond.
CH3-CH2* / *CH2-CH3
وبعد عدد معين من الخطوات, سيتم الحصول على ألكان وألكين من عدة انواع : CH3-CH3 + CH2=CH2
الإحتمال الثالث (14 %) تكسر الرابطة C-H
وبعد عدد معين من الخطوات, سيتم الحصول على ألكين وغاز هيدروكربوني: CH2=CH-CH2-CH3 + H2
تفاعلات الهلجنة
R + X2 → RX + HX
الخطوات الآتية تمثل عملية كلورة الميثان. وهو تفاعل تفاعل طارد للحرارة بشدة, وقد يؤدى إلى إنفجار.
1. خطوة البداية: فصل جزيء الكلور لتكوين ذرتين كلور. وكل ذرة كلور لديها 2 إلكترون حر تتصرف كشق حر.
Cl2 → Cl* / *Cl
يتك إمداد التفاعل بالطاقة عن طريق UV
2. الإنتشار (خطوتين): تسحب ذرة هيدروجين من الميثان ثم يقوم الميثيل بسحب ذرة كلور من Cl2.
CH4 + Cl* → CH3* + HCl
CH3* + Cl2 → CH3Cl + Cl*
وهذا ينتج المركب المطلوب بالإضافة إلى جذر كلور أخر. ويقوم هذا الجذر بخطة إنتشار أخرى ويسبب إستمرار تسلسل التفاعل. وفى حالة وجود زيادة في الكلور, فإنه من الممكن تكون نواتج أخرى مثل CH2Cl2.
3. خطوة الإنتهاء: إعادة اتحاد جذرين حرين من الكلور .
Cl* + Cl* → Cl2, أو
CH3* + Cl* → CH3Cl, أو
CH3* + CH3* → C2H6.
الإحتمال الأخير لخطوة الإنتهاء يؤدى إلى عدم نقاء الخليط الناتج, ومن الواضح في هذا التفاعل أنه نوتجه لها سلسلة كربونية أكبر من المتفاعلات
الإحتراق
R + O2 → CO2 + H2O + H2
الإحتراق تفاعل طارد للحرارة بشدة. وفى حالة عدم كفاية الأكسجين O2, فسيؤدى هذا لتكون غاز أول أكسيد كربون (CO) السام. المثال الآتى للميثان:
CH4 + 2 O2 → CO2 + 2 H2O
عند عدم توفر الأكسجين O2:
2CH4 + 3 O2 → 2 CO + 4 H2O
وفى حالة أن الأكسجين O2 أقل:
CH4 + O2 → C + 2 H2O
الألكينات
الألكين في الكيمياء العضوية هو هيدروكربون غير متشبع يحتوى على الأقل رابطة واحدة ثنائية بين ذرتي كربون. تكون الألكينات البسيطة التى تحتوى على رابطة واحدة مزدوجة سلسلة متجانسة, والألكينات لها المعادلة العامة CnH2n.
أبسط الألكينات هو الذى يعرف بإسم "إثيلين" بينما الإسم الرسمية له طبقا للإتحاد الدولي للكيمياء والكيمياء التطبيقية (IUPAC) يسمي إثين.
تركيب الألكينات
شكل الألكينات
كما هو منوقع طبقا لهندسة الجزيء فإنه يحدث تنافر بين زوج الإلكترونات (شاهد "الرابطة التساهمية"), وبالتالى فإن الزاوية بين ذرتي الكربون في الرابطة المزدوجة ستكون 120°, وقد تصبح الزاوية أكبر طبقا للإجهاد الواقع من التفاعلات الغير إرتباطية التى تحدث من المجموعات المرتبطة بذرة الكربون. فمثلا الزاوية بين C-C-C في البروبين (البروبيلين) تبلغ 123.9123.9°.
الهندسة الجزيئية للرابطة المزدوجة بين ذرتي كربون
مثل الرابطة التساهمية الأحادية, فإنه يمكن وصف الرابطة المزدوجة بكيفية التداخل الحادث بين المدارات الذرية, فيما عدا أنه بعكس الرابطة الأحادية (والتى تتكون من رابطة سيجما واحدة), فإن الرابطة المزدوجة بين الكربون تتكون من رابطة سيجما ورابطة باي.
تستعمل كل ذرة كربون في الرابطة المزدوجة مداراتها sp2 المهجنة لتكون رابطة سيجما لثلاث ذرات أخرى. بينما المدارات الذرية 2p الغير مهجنة, والتى تقع عموديا على مستوى المتكون من محاور مدارات sp2 المهجنة, لتكوين رابطة باي.
ونظرا لأنه يتطلب كمية كبيرة من الطاقة لكسر الرابطة باي (264 كيلو جول لكل مول في الإثيلين), فإن الدوران حول الرابطة كربون-كربون المزدوجة صعب للغاية ومقيد بشدة.
الخواص الفيزيائية
تقريبا مثل الألكانات.
تعتمد الحالة الفيزيائية على الكتلة الجزيئية
الخواص الكيميائية
الألكينات بصفة عامة مركبات ثابتة, ولكنها أنشط من الألكانات.
التفاعلات
تصنيع الألكينات
*أكثر الطرق الصناعية شيوعا لتصنيع الألكينات هى تكسير البترول
*يمكن تصنيع الألكينات من الكحولات خلاف تفاعلات النزع والتى يتم فيها نزع جزيء ماء من الجزيء
H3C-CH2-OH + H2SO4 → H3C-CH2-O-SO3H + H2O → H2C=CH2 + H2SO4
*التصنيع الحفزي للألكينات الكبيرة من النوع α-ألكين والتى يمكن الحصول عليها من تفاعل الإثيلين مع ثلاثي إثيل الألومنيوم, مركب عضوي فلزي في تواجد النيكل, أو الكوبالت, أو البلاتين.
تفاعلات الإضافة
إضافة حفزية للهيدروجين
الهدرجة الحفزية للألكينات تنتج الألكان المقابل. يتم التفاعل تحت الضغط في وجود عامل حفز فلزي. ومن الحفازات الصناعية الشائعة الإستخدام البلاتين, النيكل, البلاديوم, وذلك للإستخدام في المعامل. وغالبا ما يستخدم نيكل راني, وهو سبيكة من النيكا والألومنيوم.
المعادلة القادمة توضح هدرجة الإثيلين للحصول على الإيثان:
CH2=CH2 + H2 → CH3-CH3.
إضافة شغوفة بالإلكترونات
معظم تفاعلات الإضافة للألكينات تتبع آلية تشابه الإضافة الشغوفة بالإلكترونات.
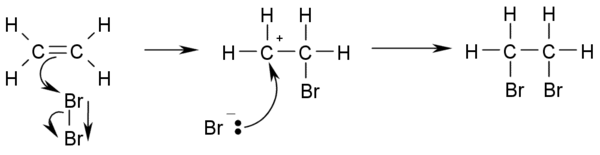
الهلجنة:إضافة البروم, أو الكلور في حالتهم العنصرية إلى الألكينات وينتج ثنائي برومو فيسينال ، وثنائي كلورو ألكين, بالترتيب. وعملية نزع الكلور من محلول البروم في الماء هى طريقة تحليلية لإختبار وجود الألكين:
CH2=CH2 + Br2 → BrCH2-CH2Br
وهذه هى آلية التفاعل:
ويسير التفاعل بسبب الكثافة الإلكترونية العالية الموجودة على الرابطة الثنائية والتى تسبب إرزاحة مؤقتة للإلكترونات في الرابطة B-B مما يسبب حث مؤقت ثنائى القطب. وهذا يجعل Br يقترب من الرابطة الثنائية الموجبة وعند ذلك يحدث هيدروهلجنة محبة للإلكترونات: إضافة حمض هيدروهاليد مثل HCl أو HBr للألكين وينتج الهالو ألكان المقابل. .
CH3-CH=CH2 + HBr → CH3-CHBr- ولو أن ذرتي الكربون عند الرابطة الثنائية مرتبطتان لعدد مختلف من ذرات الهيدروجين, فإن الهالوجين يتجه لذرة الكربون التى بها عدد ذرات هيدروجين أقل (قاعدة ماركونيكوف).
وألية التفاعل:
إضافة الكربين أو الكاربينويد ينتج البروبان الحلقي المقابل.